

El Comité ético-científico de Ciencias de la Salud es un organismo colegiado, consultor y asesor en el área de ética en investigación biomédica. Comienza a funcionar a partir del 29 de enero del 2014 como resultado de la fusión de los Comités de Ética en Investigación de la Escuela de Medicina y Escuela de Enfermería con el nombre de CEC-Med UC, alojado administrativamente en la Facultad de Medicina de la Universidad.
En el año 2020 se traspasa administrativamente a la Vicerrectoría de Investigación con el apoyo de la gestión de la Unidad de Ética y Seguridad en investigación, cambiando su nombre a CEC-Salud UC.
La misión del CEC-Salud UC es velar por que las actividades de investigación biomédica y académica que se desarrollan en la Pontificia Universidad Católica de Chile cumplan con los principios básicos sustentados en los valores éticos y, promover entre la comunidad académica y científica la reflexión colectiva sobre el correcto quehacer, la pertinencia y la proyección de la investigación en beneficio de la sociedad. Para ello, las evaluaciones consideran tanto los aspectos éticos y científicos del protocolo de investigación, la competencia del equipo investigador, tanto el proceso y documento de consentimiento informado y la verificación de la compensación por daños, entre otros.
Por otra parte, los miembros del Comité se capacitan de manera permanente, promueven la educación a los miembros de la institución y la comunidad, y apoyan la difusión de la bioética y ética de la investigación.

Todo lo anterior con el fin de garantizar la seguridad de los participantes involucrados en investigaciones científicas, de acuerdo con la normativa nacional e internacional vigente y que todo estudio que involucre a personas cumpla con los principios éticos, el rigor científico y conducción administrativa, para alcanzar la investigación de excelencia.
El CEC Salud UC desde el año 2014 (Resolución Exenta Nº 018526 el 31 de marzo de 2014) cuenta con la acreditación oficial de la SEREMI, condición que ha logrado mantenerse hasta la actualidad, en cumplimiento a las exigencias de normativa vigente.
La acreditación asegura un estándar de funcionamiento del comité acorde a las indicaciones y regulaciones de la autoridad sanitaria nacional. Para mantener activa esta acreditación, los comités tienen la responsabilidad de dar cuenta del cumplimiento de los requisitos exigidos de acuerdo a la Norma General Técnica N° 151, asociado a la Resolución Exenta N° 403 del 11 de julio del 2013.
Respecto los procesos consecutivos de re-acreditación que ha logrado el CEC Salud UC, se pueden destacar los siguientes hitos:
El comité recibió la representante de la SEREMI de Salud, en virtud del programa de fiscalización y re-acreditación a los Comités Éticos Científicos a nivel nacional. En esta visita se revisaron las actividades realizadas por el CEC durante el año 2016 y el cumplimiento a las observaciones emitidas en la visita ese año, las que resultaron cumplidas de forma satisfactoria. De este modo, y dando cumplimiento de las obligaciones del CEC, fue re-acreditado por Resolución N°012321 acreditación con fecha 07 de junio de 2017.
Desde inicios del año 2020, el comité comenzó con el trabajo de actualización de documentación correspondiente y solicita la reacreditación ante la SEREMI de Salud. Sin embargo, debido a la contingencia sanitaria nacional, la SEREMI de Salud Pública indica que, debido al Estado de Excepción Constitucional de Catástrofe, para el año 2020 se mantendrá la acreditación vigente.
A fines del primer semestre del 2021, momento en el cual la situación de pandemia se encontraba más controlada y las instituciones se abrían progresivamente a la modalidad de atención presencial, se activó la solicitud de parte del comité para la reacreditación. Esta se obtuvo oficialmente según Resolución Exenta Nº012793 del 27 de octubre 2021, luego de la visita de la representante de la SEREMI en agosto y del proceso de subsanaciones que tuvo como fecha límite el 28 de septiembre de 2021.
En el mes de noviembre del 2022, para dar cumplimiento a lo indicado en la Circular N°A15/03 del 27 de abril de 2016, se realizó la visita de supervisión en terreno, posterior al proceso de reacreditación al comité. El 28 de noviembre del 2022, la representante de la SEREMI, Referente regional acreditación y supervisión Comités Ético Científicos, entrega el Acta oficial de la visita nº259672, la cual se obtuvo sin ninguna observación.

| MIEMBRO | UNIDAD | CARGO |
|---|---|---|
| Sra. Ivonne Vargas Celis | Escuela de Enfermería | Presidenta |
| Sr. Francisco Acevedo Claros | Departamento Hematología Oncológica | Vicepresidente |
| Srta. Mónica Vergara Quezada | Unidad de Ética y Seguridad en Investigación | Secretaria ejecutiva |
| Sr. Jorge Muñoz Castillo | Sin filiación UC | Abogado |
| Sr. Juan Francisco Miquel | Departamento de Gastroenterología | Experto en GCP |
| Sr. Luis Villarroel Del Pino | Departamento de Salud Pública | Experto en Metodología de la Investigación |
| Sra. Ana María Verdugo | Sin filiación UC | Representante de la Comunidad |
| Sr. Nicolás Quintanilla Rojas | Unidad de Ética y Seguridad en Investigación | Secretario ejecutivo/subrogante Experto en GCP |
| Srta. Constanza Richard Yáñez | Sin filiación UC | Abogada/subrogante |
| Sra. Angélica Lagos Segura | Sin filiación UC | Representante de la Comunidad/subrogante |
| Sra. Mónica Cifuentes Soro | Sin filiación UC | Encargada EAS |
| Sra. Ximena Ortega Fuenzalida | Sin filiación UC | Miembro regular |
| Sra. Caren Aguilera Silva | Unidad de Ética y Seguridad en Investigación | Miembro regular |
| Sra. Carolina Llanos Muñoz | Departamento de Inmunología y Reumatología | Miembro regular |
| Sr. Diego García-Huidobro | Departamento de Medicina Familiar | Miembro regular |
| Sr. Gonzalo Varas Díaz | Departamento de Ciencias de la Salud | Miembro regular |
| Sr. Jorge Jalil Milad | Departamento de Cardiología | Miembro regular |
| Sra. Katia Abarca Villaseca | Departamento Infectología | Miembro regular |
| Sra. Leyla Alegría Vargas | Departamento de Medicina Intensiva | Miembro regular |
| Sra. María Jesús Vega Salas | Departamento de Ciencias de la Salud | Miembro regular |
| Sra. Marisa Torres Hidalgo | Departamento de Salud Pública | Miembro regular |
| Sra. Paula Ford Guajardo | Escuela de Odontología. | Miembro regular |
| Sra. Rina González Briones | Escuela de Enfermería | Miembro regular |
| Sr. Víctor Contreras Ibacache | Departamento de Anestesia | Miembro regular |
En esta sección los académicos e investigadores pueden acceder al Reglamento Interno del CEC de Ciencias de la Salud.
Toda investigación realizada en seres humanos debe hacerse de acuerdo al menos tres principios éticos básicos: el respeto a las personas (principio de autonomía), búsqueda del bien (principio de beneficencia y de no-maleficencia) y la justicia. En general, hay acuerdo que estos principios – en teoría de igual fuerza moral- son los que guían la preparación prolija de protocolos para estudios científicos. En circunstancias diversas pueden expresarse de manera diferente y también ponderarse en forma distinta desde el punto de vista moral, y su aplicación puede dar lugar a decisiones o cursos de acción diferentes.
El comité pone a disposición de los investigadores la doctrina nacional e internacional que rige a las investigaciones científicas en materia de ética e integridad en las investigaciones científicas con personas en el ámbito de la salud.
Código de Nüremberg (1946)
Este Código estableció las normas para llevar a cabo experimentos con seres humanos, incidiendo especialmente en la obtención del consentimiento voluntario de la persona, que, desde entonces, se ha considerado como la piedra angular de la protección de los derechos de los pacientes.
Declaración de Helsinki
Este documento fue promulgado por la Asociación Médica Mundial (AMM) en 1962 y que ha tenido varias actualizaciones, siendo la última en 2013. Es un cuerpo de principios éticos que guían a la comunidad médica y otras personas que se dedican a la investigación con seres humanos. Para los profesionales médicos es considerada como el documento más importante en la ética de la investigación con seres humanos, a pesar de que no es un instrumento legal que vincule internacionalmente.
Informe Belmont
Es un informe creado por el Departamento de Salud, Educación y Bienestar de los Estados Unidos, titulado “Principios éticos y pautas para la protección de los seres humanos en la investigación”, y es un importante documento histórico en el campo de la ética médica. El informe fue publicado el 30 de septiembre de 1978, y toma el nombre del Centro de Conferencias Belmont, donde el documento fue elaborado.
Los tres principios éticos fundamentales para usar sujetos humanos en la investigación son:
Hoy este documento continúa siendo una referencia esencial para que los investigadores y grupos que trabajan con sujetos humanos en investigación se aseguren que los proyectos cumplen con los estándares éticos.
Buenas Prácticas Clínicas
Las normas de buena práctica clínica (BPC) proporcionan un marco de principios que tienen por objeto garantizar la seguridad de los participantes en la investigación y la integridad y validez de los datos. Este cursillo tiene como objetivo proporcionar al investigador los principios básicos de la BPC y la forma en que estos pueden ser aplicados en la práctica en el ámbito de la investigación. El curso está dirigido a todos los agentes implicados en la investigación clínica. (https://globalhealthtrainingcentre.tghn.org/normas-de-buena-practica-clinica-ich-e6-r2/)
Declaración Universal de Bioética y derechos humanos
La Declaración Universal sobre Bioética y Derechos Humanos es el documento público más importante producido colectivamente sobre la Bioética en este siglo XXI. Su contenido transformó la agenda bioética internacional, (re)fundando su epistemología y expandiendo sus fronteras de actuación. La inclusión de las temáticas sanitarias, sociales y ambientales en el cuerpo del documento, más allá del contenido exclusivamente biomédico-biotecnológico, proporciona una mirada amplia de la ética aplicada al campo sanitario.
Pautas CIOMS
El CIOMS, en asociación con la Organización Mundial de la Salud, dio inicio a sus trabajos sobre ética de la investigación relacionada con la salud a fines de los años setenta. Desde entonces se dispuso, en cooperación con la OMS, a preparar pautas para indicar la manera de aplicar de manera efectiva los principios éticos sobre todo en los entornos de escasos recursos, Desde entonces se publicaron ediciones revisadas de las pautas éticas del CIOMS en 1993, 2002 y 2016. El Consejo subraya la necesidad de que las investigaciones tengan valor social y científico, define pautas especiales para la investigación relacionada con la salud, detalla las medidas que han de tomarse para incluir a personas vulnerables en la investigación y describe en qué condiciones pueden usar las muestras biológicas y los datos relacionados con la salud en la investigación.
Leyes
Ley 20850. Crea un sistema de protección financiera para diagnósticos y tratamientos de alto costo.
Esta Ley es de carácter universal, asegurado por FONASA a todos los beneficiarios de los sistemas previsionales de salud de Chile. Esto es, ISAPRES, Fonasa y las Instituciones de Salud Previsional de las Fuerzas Armadas y de Orden y de Seguridad Pública.
Nueva Ley 20584. Regula los derechos y deberes que tienen las personas en relación con acciones vinculadas a su atención en salud.
Lo que busca esta norma es mejorar la relación que existe entre los prestadores de servicios de salud (instituciones, equipo médico, técnicos, auxiliares y administrativos) y sus usuarios, para lo cual establece una serie de aspectos que deben ser respetados y cumplidos por ambas partes. Para los proyectos de investigación es importante revisar el Art. 28, de esta Ley, que se refiere a la capacidad de consentir.
Ley 20120. Sobre la investigación científica en el ser humano, su genoma y prohíbe la clonación humana.
En su primer artículo, esta Ley establece que tiene por finalidad proteger la vida de los seres humanos, desde el momento de la concepción, su integridad física y psíquica, así como su diversidad e identidad genética, en relación con la investigación científica biomédica y sus aplicaciones clínicas. En su artículo 10, la Ley amplía su alcance más allá de la investigación científica biomédica al explicitar que “Toda investigación científica en seres humanos que implique algún tipo de intervención física o psíquica deberá ser realizada siempre por profesionales idóneos en la materia, justificarse en su objetivo y metodología y ajustarse en todo a lo dispuesto en esta ley.”
Ley 19628. Sobre protección de la vida privada
Esta Ley establece las condiciones en que se puede hacer uso de datos personales que no sean propios. Dice en su primer artículo que “Toda persona puede efectuar el tratamiento de datos personales, siempre que lo haga de manera concordante con esta ley y para finalidades permitidas por el ordenamiento jurídico. En todo caso deberá respetar el pleno ejercicio de los derechos fundamentales de los titulares de los datos y de las facultades que esta ley les reconoce.”
Decretos
Decreto 38. Aprueba reglamento sobre derechos y deberes de las personas en relación con las actividades vinculadas con su atención de salud
D.S 114. Aprueba Reglamento de la Ley núm. 20.120. Sobre la Investigación Científica en el Ser Humano, su genoma, y prohíbe la clonación Humana.
Decreto exento 1284. (Norma técnica 173). Buenas prácticas de manufactura (BPM) para productos farmacéuticos destinados al uso de investigaciones científicas en seres humanos
Resoluciones Exentas
R.E. 183. Modifica Resolución Exenta N° 403, de fecha 11 de julio de 2013, del Ministerio de Salud y mediante la cual se aprobó la Norma Técnica N° 151 sobre estándares de acreditación de los Comités Científicos
R.E. 273. Aprueba Guía Técnica «Otorga Lineamientos y Orientación para la realización de Estudios Clínicos con Productos Biológicos»
R.E. 403. Aprueba Norma Técnica N°151 sobre estándares de acreditación de Comités Ético Científicos.
R.E. 441. Establece y actualiza el proceso de notificación de eventos adversos ocurridos en ensayos clínicos que se desarrollan en Chile
R.E. 5161. Actualiza Guía para la autorización y control del uso de productos farmacéuticos de investigación científica y deroga las resoluciones números 403 y 2.263, ambas de 2015.
R.E. 5174. Actualiza Guía de Inspección de Estudios Clínicos Farmacológicos del Instituto de Salud Pública de Chile.
R.E. A27. Aprueba Guía para el adecuado almacenamiento de los productos farmacéuticos utilizados en investigación científica
Normas
Norma Técnica 57 MINSAL. Regulación de la ejecución de ensayos clínicos que utilizan productos farmacéuticos en seres humanos
“Según lo establecido en el Código Sanitario y en el Reglamento del Sistema Nacional de Control de Productos Farmacéuticos, Alimentos de uso Médico y Cosméticos, aprobado por decreto supremo 1.876 de 1995, Ministerio de Salud, le corresponde al director del Instituto de Salud Pública de Chile otorgar la autorización para el uso provisional de productos farmacéuticos para fines de investigación científica o ensayos clínicos, sin registro previo y mediante resolución fundada” (N.T 57, pág 9).
Circulares
Circular Nº 4 ISP. Aclara y actualiza los requisitos y condiciones de autorizaciones de uso de productos farmacéuticos sin registro sanitario para fines de investigación científica y sus modificaciones
C. A15/ 40 Minsal. Difunde pautas de auto-evaluación para el proceso de acreditación de comités ético-científicos
C. A15/ 46 Minsal. Complementa pautas de auto-evaluación para el proceso de acreditación de Comités ético-científicos, difundidas por Circular A15 N°40/2013. Se adjunta anexo con formularios para dichos procesos
A15/01/2016. Difunde guía para el proceso de acreditación y supervisión de comités ético científicos por parte de las secretarías regionales ministeriales de salud.
B1/2015. Establece procedimiento para registro nacional de acreditaciones de comités éticos científicos
B6/2015 Minsal. Difunde guía para el proceso de acreditación y supervisión de comités científicos por parte de las secretarías regionales ministeriales de salud
Los Comités ético-científicos y de seguridad (CEC) de la UC respondiendo a los estándares de transparencia y calidad exigidos por directrices internacionales, normativa nacional y regulaciones de la universidad, anualmente publican sus Memorias.
Estos documentos sintetizan el trabajo anual de los Comités, detallando el número de investigaciones evaluadas, enmiendas y seguimientos éticos, entre otros aspectos. Además de la participación los miembros de los CEC en instancias de formación y capacitación a la comunidad.
Toda investigación UC debe ingresar a la plataforma de evaluación ética. Corresponde al registro oficial de la universidad. Pueden registrarse investigadores (académicos) UC e investigadores externos (académicos externos siempre con sus contrapartes UC). Corresponde a un registro inicial del proyecto, con los datos generales de éste y de los investigadores. En un plazo máximo de 5 días hábiles el/la investigador/a recibirá un Certificado de Recepción de la Solicitud, el cual además podrá descargar del sistema de evaluación.

Tipos de estudios que son evaluados por el Comité
Un Comité Ético Científico evaluará toda investigación científica a realizarse en seres humanos. Independiente del financiamiento que el proyecto/estudio presente, tal como lo señala en el artículo 10 de la Ley 20.120, Sobre la investigación científica en el ser humano, su genoma, y prohíbe la clonación humana.
El CEC Salud UC evalúa todo proyecto de investigación científica que implique una intervención física o psíquica o interacción con seres humanos con el objetivo de mejorar la prevención, diagnóstico, tratamiento, manejo y rehabilitación de la salud de las personas o de incrementar el conocimiento biomédico del ser humano. Asimismo, aquel protocolo, estudio o proyecto de investigación científica que considere el uso de material humano (tejidos, fluidos, órganos entre otros) o de información disponible identificable (genes) a la luz de lo definido por la legislación vigente.
Las actuales regulaciones en nuestro país establecen que “el que desarrollare un proyecto de investigación científica biomédica en seres humanos o en su genoma, sin contar con las autorizaciones correspondientes exigidas por ley, será sancionado con la suspensión por tres años del ejercicio profesional y con la prohibición absoluta de ejercicio profesional en el territorio nacional en caso de reincidencia” (Ley 20.120).
Otras evaluaciones del CEC
En las últimas décadas, la generación de Biobancos se ha vuelto una práctica rutinaria en el cuidado de la salud humana y la investigación Biomédica, dado que constituyen un valioso insumo para la generación de proyectos de investigación y nuevo conocimiento.
Los Biobancos “son instituciones o centros de conservación públicos o privados”, donde en condiciones adecuadas, se acogen y almacenan colecciones organizadas de material biológico como células, tejidos, fluidos corporales y datos biológicos, incluyendo información genética, demográfica y otros tipos de información e imágenes. contribuyendo al desarrollo de proyectos de investigación futura en distintas áreas de la salud.
Los biobancos representan una valiosa herramienta para el avance de la investigación biomédica, pero también, plantean importantes desafíos éticos. Abordar estas consideraciones con seriedad y rigor, tanto para la generación, administración y custodia de Biobancos, es esencial para proteger los derechos de los donantes y fomentar la confianza pública en la investigación científica. La implementación de políticas claras y la supervisión ética continua son fundamentales para asegurar que los biobancos operen de manera ética y responsable. En nuestra Institución, la autorización Ético-científica de la implementación y custodia de un Biobanco dependiente de la Facultad de Medicina de la Pontificia Universidad Católica de Chile, recae en el CEC Salud UC.
La directriz ética se basa en que los biobancos son una fuente de insumos para desarrollar investigaciones relacionadas con la salud humana y el origen de estas muestras son humanos, por lo que deben adquirirse previo consentimiento informado. Con el fin de resguardar el derecho de protección, seguridad y bienestar de las personas que son donantes de muestras para los biobancos, tanto la normativa legal nacional e internacional como la literatura científica y consensos internacionales proponen como una prioridad la necesidad y pertinencia de evaluación ética y científica de los Bionbancos, desde su generación hasta su gobernanza y buenas prácticas.
Siguiendo la normativa internacional, al crear un biobanco se debe contar con mecanismos de gobernanza institucional donde se “plantee el esquema de articulación de la organizacional (roles) e institucionalidad (como normas que dan atribuciones)” encargados de brindar los servicios establecidos y las soluciones en caso de permitir a otros investigadores el acceso a los recursos disponibles de un bionbanco de una manera sistemática y regulada.
El o los materiales biológicos para investigar, recolectadas en un Biobanco, pueden recolectarse expresamente para un propósito específico de investigación o pueden ser utilizados también en investigaciones futuras. Para el momento de la recolección, aunque no se tenga precisión de cuáles serán los proyectos de investigación que harán uso de las muestras o datos asociados, existe el documento de consentimiento informado de uso amplio (CIA). Este documento tiene como objetivo entregar información importante, desdelos riesgos y beneficios posibles de un procedimiento o tratamiento médico o uso de la información contenida, inclusive en el ámbito genético, para ayudar a los pacientes/participantes a decidir si se quieren someter o no someter al proceso y así como recibir información nueva que pudiera afectar su decisión de continuar.
Los documentos para solicitar evaluación ética de un Biobanco están disponibles en esta página web en la sección plantillas.
Fuentes:
Consideraciones generales:
La carta de autorización del director del centro debe ser tramitada por el Investigador Responsable posterior a la aprobación del Comité Ético científico directamente con la dirección del centro correspondiente.
Si el reclutamiento y/o ejecución de las intervenciones se realiza en dependencias académicas de la UC se debe seguir el procedimiento descrito a continuación.
Para solicitar esta autorización se ha definido proceder de la siguiente forma:
Estudios académicos
Corresponden a estudios de investigación biomédica, realizados por académicos UC o estudiantes de post – grado de nuestra universidad.
Entre ellos se consideran principalmente aquellos con financiamiento ANID: FONDECYT (iniciación, regular, post-doctoral), financiamiento interno UC, etc. O aquellos que se realizan sin financiamiento.
Es importante considerar que para este tipo estudios y su evaluación ética, es que para algunos concursos (con financiamiento del Estado), es requisito contar con el acta de aprobación ética en plazos establecidos en los contratos de adjudicación, para la transferencia de fondos, motivo por el cual es fundamental los/as investigadores/as deben considerar, los márgenes oportunos de tiempo para someter sus estudios a evaluación
Estudios Multicéntricos
Corresponden a estudios que, en su diseño y ejecución, vinculan a más de un centro colaborador en el territorio nacional.
Estudios de la industria farmacéutica
Son estudios o proyectos clínicos (por encargo) cuentan con financiamiento (patrocinio) de la industria farmacéutica, y por su naturaleza, están regulados tanto a nivel nacional e internacional. Estos estudios promueven el desarrollo de nuevos medicamentos y/o dispositivos médicos para el tratamiento y prevención de enfermedades.
La legislación chilena (Ley. 20.850) establece que uno de los requisitos de este tipo de estudios es contar con una pòliza de seguro para los participantes (seguro de responsabilidad civil ensayos clínicos).
Sólo una vez que han sido aprobados por el Comité ético científico pueden solicitar autorización a la autoridad regulatoria Instituto de salud pública (ISP) para su definitiva autorización y ejecución. Para más información o en caso de dudas consultar a la coordinadora cfaguileras@uc.cl
Estudios realizados en personas adultas sin capacidad de consentir
En los estudios de investigación que incluyan a adultos con incapacidad física o mental de expresar su consentimiento o de quienes no se pueda conocer su preferencia, se debe cumplir lo establecido en el artículo 28 de la ley 20.584 (link de la ley).
Para ser aprobado por el CEC Salud UC, toda propuesta de investigación enmarcada en la ley previamente descrita, debe cumplir con los siguientes requisitos mínimos:
Es importante destacar que una vez el proyecto de investigación sea aprobado por el CEC Salud UC, el Investigador Responsable debe obtener la autorización de la autoridad sanitaria competente (SEREMI de Salud) antes de comenzar la ejecución.
Proceso de evaluación ética de proyectos de investigación
El proceso de evaluación ética de nuevos proyectos de investigación biomédica con personas que evalúa el CEC Salud UC, abarca a todos aquellos que sean conducidos por académicos/as y estudiantes de postgrado de la Pontificia Universidad Católica o que sean realizados en sus dependencias.
El proceso de evaluación se inicia con la presentación de los estudios y culmina con el término formal y administrativo de los mismos, abarcando incluso etapas evaluativas durante su desarrollo (proyectos vigentes). Para ello, como parte de la “ruta de evaluación ética de proyectos de investigación” es posible reconocer los siguientes subprocesos (los cuales se describirán en detalle en la sección siguiente):
Pasos para la presentación de antecedentes de proyectos de investigación biomédica a evaluación ética.
Pasos parar la Evaluación original de nuevos estudios
En el desarrollo de esta fase es posible distinguir dos tipos de revisiones:
. Estudios académicos con personas o con uso de datos
. Estudios multicéntricos con personas
. Estudios clínicos de la Industria Farmacéutica
. Estudios vinculados al artículo 28 de la ley
El equipo de pre- revisión se compone de los siguientes miembros
La fase debería tener una duración máxima de tres semanas, pero esto es flexible y se extiende según el tiempo que el investigador responsable se demore en responder a las sugerencias y comentarios del pre-revisor/a. La duración de un proyecto en esta fase incide directamente en el tiempo de ingreso formal del mismo al proceso de evaluación ética.
Esta etapa culmina con la derivación del estudio a sesión sesión ordinaria del CEC Salud UC.
Flujograma de Evaluación original (incluye pre- revisión)
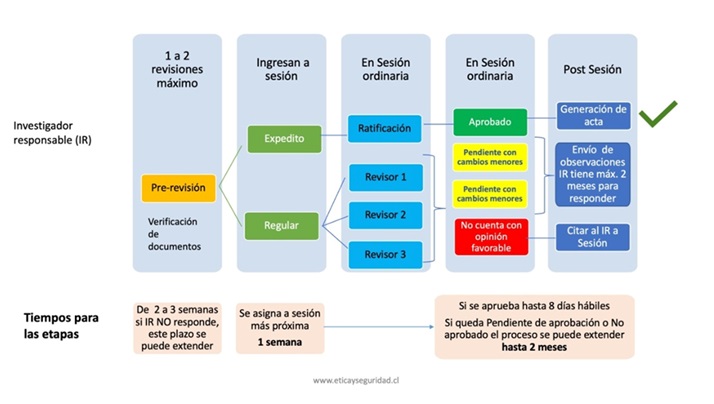
La evaluación original, refiere a primer subproceso en el proceso de evaluación ética en el desarrollo de procesos de investigación UC. A través de ella los/as investigadores someten por primera vez documentación al comité ético – científico de ciencias de la salud, presentando su estudio.
El ingreso de un nuevo estudio a sesión implica necesariamente su paso por la etapa de pre- revisión (de la cual se entrega detalles en el apartado correspondiente). Es a través de ella que el estudio se categoriza para ingreso a sesión entre las siguientes categorías:
Hay estudios que ingresan directamente como regulares para ser discutidos en sesión, estos son:
Para todo estudio regular, luego de la discusión en sesión y una vez se toman algunos acuerdos respecto de la evaluación del estudio, esto se consigna en acta de sesión, siendo las siguientes, las alternativas de evaluación posible:
En el primer caso, el estudio contará con su acta de aprobación ética a través de la plataforma en un plazo aproximado máximo de 7 días hábiles a contar del día siguiente en que se desarrolló la sesión en que fue discutido.
Para los casos 2 y 3, el investigador responsable (IR) del estudio debe realizar ciertos ajustes al estudio acorde a las observaciones emanadas de la discusión realizada en la sesión del CEC Salud UC. Para ello, las observaciones, consignadas en acta de la sesión, se disponibilizan a través de la plataforma al IR (específicamente en el punto 9: Comentarios generales de la evaluación) con un plazo máximo de 2 días hábiles.
El/la IR tiene un plazo máximo de dos meses, desde disponibilizadas las observaciones, para responder a ellas. Formalmente en esta situación, los estudios pasan a una etapa identificada como RE- INGRESO de nuevo estudio para evaluación original (ver detalle en la sección correspondiente).
Respecto la situación plateada en el cuarto caso, se emite un acta de con resultado de evaluación ética no favorable.
3.a. Re – ingreso:
Corresponde al estado en que se identifica a un nuevo estudio, que habiendo presentado antecedentes para evaluación ética, el Comité resuelve en sesión que el estudio aún no está en condiciones de obtener aprobación, en tanto se identifican aspectos a subsanar.
Los resultados posibles para los estudios respecto de los cuales se identifican aspectos a subsanar son dos:
Por normativa interna del CEC Salud UC, los/as investigadores/as tiene un plazo máximo de dos meses (contados desde el día en que se disponibilizan las observaciones de la evaluación original, a través de la plataforma de evaluación ética) para responder.
¿Qué es una enmienda?
El subproceso de Enmienda es cualquier modificación al proyecto de investigación, que ha sido revisado y aprobado por el CEC Salud UC originalmente, implicando cambios o adición a la documentación, derivada de variaciones a la estructura metodológica, cambios administrativos, sustitución del investigador principal o ante la identificación de riesgos en los sujetos de investigación, entre otros.
Los documentos susceptibles de enmienda son:
Qué se debe realizar para solicitar una enmienda?
¿Qué debe contener la carta de enmienda?
La carta de sometimiento enmienda debe detallar en qué consiste ésta, es decir, dar cuenta de los cambios que se efectuarán a la investigación y detallar las modificaciones que esto conlleva en contraste al diseño original previamente aprobado por el Comité. Además, esta carta debe contener la justificación de por qué se realiza la solicitud de enmienda y señalar el estado actual en que se encuentra la investigación (reclutamiento activo, en seguimiento a los participantes, análisis de datos, reclutamiento cerrado, etc.). Por último, se debe enlistar la documentación que se modifica o presenta a propósito de la enmienda para su aprobación ética, con el nombre, versión y fecha respectiva (esta denominación será la que se señalará en acta de resolución una vez se aprueben los documentos).
¿Qué otro documento se debe subir a plataforma?
Junto al documento de carta de enmienda debe subirse a la plataforma el resto de los documentos que se requerirán para la gestión de la enmienda (debe adjuntar los documentos con control de cambio o destacado en amarillo). Entre estos documentos podrían estar, por ejemplo, nuevas versiones del protocolo, formulario de evaluación ética, nuevos instrumentos, consentimientos informados, invitaciones a participantes, entre otros, si es que estos han sido modificados. Para mayor claridad respecto a los documentos mínimos que respalden la solicitud de enmienda puede revisar el siguiente link.
¿Cuándo se debe presentar una enmienda?
Cualquier enmienda debe ser presentada antes de realizar los cambios en la investigación. El/la investigador/a no puede realizar los cambios si no tiene la aprobación ética correspondiente.
¿Cuándo será revisada y aprobada la enmienda?
Las solicitudes de enmienda son revisadas por el equipo de revisión de enmiendas del CEC Salud UC 5 días hábiles previo a la sesión más próxima de comité, sin embargo, este tiempo puede variar según el número de solicitudes de enmiendas ingresadas al Comité. Si la enmienda cuenta con todos los requerimientos para ser aprobada, será ingresada a la sesión más próxima para su aprobación por el CEC en pleno. En caso contrario, se informará al investigador/a las observaciones a su sometimiento, las cuales debe responder/subsanar a través de una carta de respuesta a observaciones y los documentos corregidos (punto a punto) para ser reasignado a evaluación.
¿Qué es una renovación?
El subproceso de Renovación corresponde a la solicitud de extensión de la vigencia de la aprobación ética de un proyecto. Esta vigencia tiene una duración de un año, contándose desde la fecha de aprobación original del proyecto en sesión del Comité, la que queda consignada en el acta de aprobación original (inicial).
La vigencia ética debe tenerse a lo largo de la duración completa del proyecto, por tanto, debe solicitar una renovación anual cada año, según extensión de la investigación.
Este subproceso debe ser solicitado por el Investigador Responsable mediante un informe del estado actual del estudio indicando información relevante acerca de la conducción de este, al menos 30 días antes del término del período de vigencia del proyecto.
Mientras no se apruebe la continuidad de la investigación, mediante acta de resolución escrita del CEC Salud UC, el investigador deberá detener toda actividad a propósito del proyecto, tales como, evaluación y enrolamiento de participantes, análisis de datos, etc.
¿Qué se debe realizar para solicitar una renovación?
¿Qué debe contener la carta de renovación?
La carta de renovación debe contener información relevante respecto al estado de avance del proyecto, la fecha de vencimiento de la vigencia ética del proyecto, la descripción de las actividades no realizadas por situaciones extraordinarias (y que fueron declaradas en el protocolo original) y cualquier otra información relevante que requiera presentar como antecedente al comité. Por último, se debe enlistar la documentación que anexa al sometimiento, con el nombre, versión y fecha respectiva (esta denominación será la que se señalará en acta de resolución una vez se aprueben los documentos)
¿Cuándo se debe presentar una renovación?
La solicitud de renovación debe presentarse 30 días antes del vencimiento de la vigencia ética del proyecto. La fecha de vencimiento se indica en el acta de aprobación original del proyecto o en el acta de resolución de renovación previamente aprobada.
¿Cuándo será revisada y aprobada la renovación? Las solicitudes de renovación son revisadas por el equipo de revisión de renovación del CEC Salud UC 5 días hábiles previo a la sesión de comité. Si la renovación cuenta con todos los requerimientos para ser aprobada, será ingresada a la sesión más próxima para su aprobación por el CEC en pleno. En caso contrario, se informa al investigador/a las observaciones a su sometimiento, las cuales debe responder/subsanar para ser reasignado a evaluación
¿Qué es una visita de seguimiento?
Corresponde al sub-proceso donde se realiza una visita (presencial o virtual) de revisión oficial de los documentos, instalaciones, registros y cualquier otro recurso que el Comité considere que esté relacionado con el proyecto de investigación, con el objetivo de asegurar el cumplimiento de los aspectos éticos previamente declarados por el Investigador Responsable y aprobados por el CEC Salud UC. Esta instancia se puede producir en cualquier momento del desarrollo de un proyecto de investigación que haya sido aprobado por el CEC Salud UC, previo al cierre definitivo del proyecto.
Las visitas de seguimientos se pueden clasificar en 2 tipos según su naturaleza:
¿Por qué se debe solicitar una visita de seguimiento a través de plataforma?
¿Qué se debe realizar para solicitar un seguimiento ético?
¿Qué debe contener la pauta de observación de visita de seguimiento?
La pauta de visita de seguimiento debe contener información acerca del desarrollo del estudio, dando cuenta del historial de enmiendas y renovaciones solicitadas, la forma en que se realizó el proceso de reclutamiento y consentimiento informado, la custodia de los datos, entre otros aspectos relevantes en la ejecución del estudio.
Esta información declarada, es verificada durante la visita de seguimiento, por lo que es responsabilidad del Investigador contar con la documentación de respaldo.
¿Cómo se agenda la visita de seguimiento?
Una vez activado el subproceso de seguimiento mediante plataforma de evaluación ética, el evaluador del CEC contactará con el Investigador Responsable para coordinar la visita de seguimiento, según la disponibilidad de ambas partes.
¿Cuándo será revisado y aprobado el seguimiento?
Al finalizar la visita de seguimiento, el evaluador emite un reporte de seguimiento, el cual puede dictaminar lo siguiente:
En caso de que el reporte dictamine el escenario b), el investigador Responsable debe responder/subsanar las observaciones para ser asignado a sesión de comité una vez el evaluador evalúe los nuevos antecedentes.
Corresponde al último sub-proceso de una investigación que ha sido aprobada por el CEC Salud UC.
A través de este sub-proceso, se documenta el desarrollo y cumplimiento de los objetivos de la investigación, así como la descripción de los principales productos comprometidos. Además, se pueden indicar los motivos que justifiquen un término anticipado.
Existen dos tipos de cierre:
En ambos casos, una vez revisada la solicitud de cierre por parte del CEC, se emite un acta oficial de cierre, dando cuenta del cumplimiento de informar por parte del investigador/a, concluyendo de este modo sus responsabilidades en cuanto a la evaluación ética de sus proyectos
¿Qué se debe realizar para solicitar un seguimiento ético?
Desvíos de protocolo
El CEC presenta un subproceso llamado Otros Documentos, destinado a recibir de forma permanente e inmediata todo tipo de informes o reporte sobre alguna desviación (salida) del protocolo establecido. Estas desviaciones pueden ser menores o mayores.
Esto permite verificar la integridad y buenas prácticas clínicas con que está llevando a cabo un proyecto aprobado por este CEC, además de orientar según el tipo de Desvió las acciones pertinentes que permitan al investigador aclarar dudas, subsanar o corregir el desvío, para que no afecte al participante ni la calidad de los datos que reporta.
¿Cómo se notifica un Desvió de protocolo en plataforma?
¿Cuándo será revisado y aprobado el desvió de protocolo?
La notificación será revisada por el equipo de revisión de desvió de protocolo del CEC Salud UC. Si la notificación cuenta con todos los requerimientos, se enviará carta de respuesta por parte del CEC. En caso contrario, se informará al investigador/a la necesidad de enviar más información, que debe responder/subsanar con una carta de respuesta a lo solicitado y, en su defecto, se le sugerirá la necesidad de realizar una enmienda.
Evento Adverso Serios
¿En es un evento Adverso en el contexto de una investigación?
Es cualquier ocurrencia médica (signo o síntoma) en un sujeto/participante en estudio, quien ha recibido una medicación/intervención en estudio, y que no necesariamente tenga una relación causal con este medicamento/intervención. Puede ser un signo no intencionado, imprevisto, desfavorable e involuntario (incluyendo un hallazgo anormal de laboratorio), un síntoma o enfermedad asociado temporalmente con un tratamiento, un medicamento o un procedimiento médico relacionado con el estudio.
El término “Serio” (grave) está basado en el desenlace de un evento o criterio de acción usualmente asociado con eventos que interfieren con el funcionamiento o la vida del sujeto/participante.
Todo Evento Adversos Serios (EAS) deben ser informados de manera expedita al CEC que supervisa el estudio/proyecto y si es de la industria farmacéutica además de informar al patrocinador debe informa a la autoridad regulatoria.
Escala de calificación (gravedad):
¿Cuándo debe ser reportado un EAS al Comité?
Dentro de 24 horas de la toma de conocimiento por parte del equipo de investigación toda ocurrencia en una investigación que resulte en:
Hay que recordar que en la investigación el EAS (o SAE por sus siglas en inglés) se considera desde:
¿Cómo se notifica un EAS en plataforma?
¿Cuándo será revisado y aprobado la notificación del EAS?
La notificación será revisada por el equipo de revisión de EAS del CEC Salud UC las 24 a 48 hrs siguientes al envió. Si la notificación cuenta con todos los requerimientos, se enviará carta de respuesta por parte del CEC. En caso contrario, se informará al investigador/a la necesidad de enviar más información, las cuales debe responder/subsanar a través de una carta de respuesta a lo solicitado.
¿Qué sucede si no informo los EAS?
Los CEC están autorizados por ley para velar por cumplir buenas prácticas clínicas en investigación y pueden suspender la aprobación ética vigente de un estudio que no informa los EAS notificando a las autoridades competentes.
Los EAS permiten mantener una clara información y comunicación directa con el investigador y equipo responsable, así como indagar sobre los potenciales riesgos no ponderados en el protocolo presentados en el proyecto original al CEC.
Este CEC se reserva el derecho de citar al IR al pleno en una sesión con todos los miembros de comité, frente a cualquier instancia que permita justificar, informar, aclarar o complementar información derivada del proyecto de investigación que no se allá aclarado en algunos subprocesos de este CEC.
Informes /Otros Documentos.
En todo proyecto de investigación existen informes periódicos o anuales que tienen como principales objetivos comprobar la calidad e integridad de los datos, verificando que se cumplan los principios de protección en los derechos, seguridad y bienestar de los participantes del estudio. Los informes (reportes) pueden provenir del:
Investigador responsable: los informes de tipo anuales que los investigadores hacen llegar al Comité con ello se permiten evaluar el cómo se ha llevado a cabo el estudio. El CEC puede solicitar más información si lo requiere, o pedir aclaración sobre algún apartado de lo acontecido durante el estudio.
Del equipo como el comité de Monitoreo de Datos: esta información recepcionada por el CEC permite confirmar o no la seguridad de los individuos que participan en el estudio de investigación. Incluso este sistema de información puede ser una alerta y llevar a la suspensión de estudios considerados de un alto riesgo por sobre los beneficios siendo no aceptable por las recomendaciones de buenas prácticas para los investigadores.
¿Cómo se envía un informe en plataforma?
¿Cuándo será revisado y aprobado la notificación de Otros documentos?
La notificación será revisada por el equipo de revisión Otros documentos del CEC Salud UC, usted recepcionará un acuse recibo (no es automático). Si la notificación cuenta con todos los requerimientos, se enviará carta de respuesta por parte del CEC. En caso contrario, se informará al investigador/a la necesidad de enviar más información, las cuales debe responder/subsanar a través de una carta de respuesta a lo solicitado.
En esta sección se encuentra el calendario anual de sesiones, correspondiendo a información oficial y pública por parte de este Comité.
Es responsabilidad de los investigadores presentar la documentación con antelación y cumpliendo con todos los documentos de acuerdo con la naturaleza del estudio. Es importante, estimar los tiempos destinados a pre-revisión de la documentación y a la evaluación del proyecto propiamente tal por parte del Comité, instancias necesarias para que el CEC pueda emitir una resolución respecto a la investigación.
| N° Sesión | Fecha |
|---|---|
| 1 | 05 de enero |
| 2 | 19 de enero |
| 3 | 09 de marzo |
| 4 | 23 de marzo |
| 5 | 13 de abril |
| 6 | 27 de abril |
| 7 | 11 de mayo |
| 8 | 25 de mayo |
| 9 | 01 de junio |
| 10 | 15 de junio |
| 11 | 06 de julio |
| 12 | 20 de julio |
| 13 | 03 de agosto |
| 14 | 24 de agosto |
| 15 | 07 de septiembre |
| 16 | 28 de septiembre |
| 17 | 05 de octubre |
| 18 | 19 de octubre |
| 19 | 09 de noviembre |
| 20 | 23 de noviembre |
| 21 | 07 de diciembre |
| 22 | 21 de diciembre |
Profesional Asistente de Ética de Investigación en Ciencias de la Salud
Coordinador y secretario Ejecutivo del Comité ético-científico en ciencias de la salud UC.